生体酸素プローブの開発
動画で研究内容を紹介しています。こちらから視聴してください。
私たちの体は、約60兆個の細胞からなるといわれています。この膨大な数の細胞は、絶えず血流を通じて酸素と栄養が供給されないとその機能を果たすことができません。人間が何らかの理由で呼吸できない状態に陥ると、すぐに生命が奪われてしまうのは酸素の供給が絶たれて細胞が機能しなくなってしまうためです。そのため、生体内の酸素をリアルタイムで検出することは大変重要です。
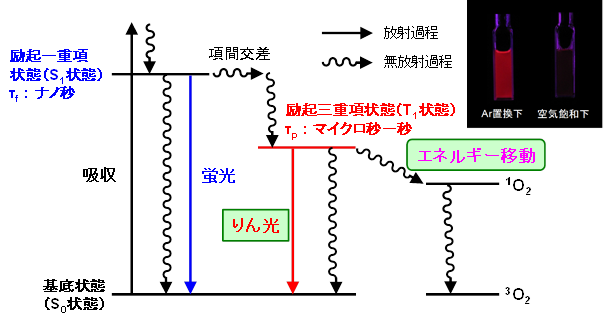
我々の研究室では、 “りん光”を利用して酸素を検出しています。一般に分子の発光は蛍光とりん光に分かれます。蛍光は励起一重項状態からの発光、りん光は励起三重項状態からの発光です。りん光は蛍光に比べて発光寿命が長いため、周囲に酸素が存在すると消光し、発光強度と発光寿命が著しく減少するという特徴をもっています。
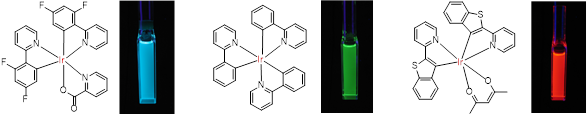
室温でりん光を示す物質は非常に少なく、主に有機金属錯体に限られます。中でもイリジウム錯体(Ir錯体)は室温で強いりん光を示す物質として知られています。このりん光を有機EL(エレクトロルミネッセンス)として利用すると、蛍光に比べて発光効率が向上することから、Ir錯体は有機EL用発光材料としても注目されています。
我々は、Ir錯体の新しい用途として、Ir錯体を用いた生体酸素プローブの開発を進めています。Ir錯体はIrイオンに結合している芳香族配位子によって様々な発光色を示します。また、配位子に親水性基や疎水性基を導入すると、Ir錯体の水溶性や細胞親和性を制御することも出来ます。このような特徴を活かして、細胞内外の酸素センシングやイメージングを可能とするプローブを設計・合成しています。また、合成した酸素プローブが目的の機能を果たしているのかを培養細胞や小動物を用いて検証しています。このように、我々は分子の設計・合成、光化学的特性、細胞・小動物実験を研究室内で実施することで、生物・医学・薬学研究者が簡便に使用できる実用性の高い酸素プローブの開発を目指しています。
細胞内酸素分圧計測・イメージング
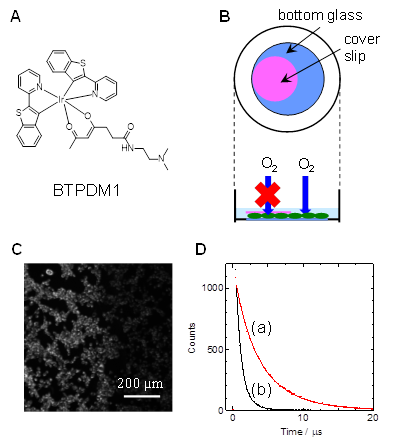
細胞内の酸素レベルを明らかにするためには、酸素プローブが効率的に細胞内に取り込まれることが必要です。我々は、ジメチルアミノ基を有する配位子を用いることで、細胞内に高効率に取り込まれるIr錯体(BTPDM1、図A)を開発し、培養細胞の酸素分圧を計測しました。
図Bは培養液を含むシャーレの底に接着して、外界から酸素の供給を受けながら生きている培養細胞を表した図です。この2次元に広がった細胞層の上を薄いガラスプレート(cover slip)で覆うとその下の細胞は上面からの酸素の供給が絶たれるため、低酸素状態に陥ると予想されます。細胞にあらかじめBTPDM1を取り込ませておいてから、ガラスプレートのエッジ付近を蛍光顕微鏡で拡大して取った画像(図C)を見ると、プレートの内側の細胞が外側の細胞に比べて強く光っているのがわかります。さらに、プレートの内側と外側でBTPDM1の発光寿命を測定したところ図Dのようになり、酸素の供給が絶たれた細胞において寿命が長い、すなわち低酸素になっていることがわかりました。この寿命の値を解析することにより、プレートの内側の細胞の酸素分圧は6.9 mmHg、外側は166 mmHgとなり、内部がかなり低酸素状態に陥っていることが明らかになりました。
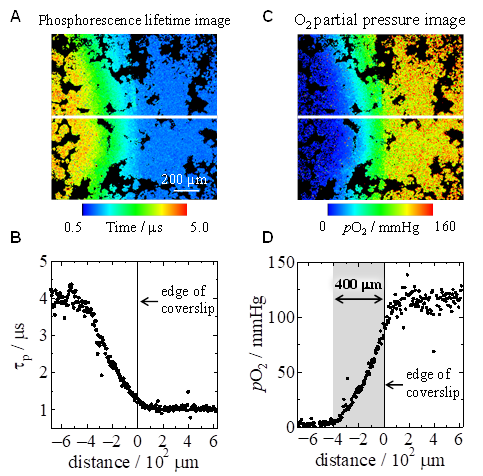
さらに、我々はエッジ付近の酸素分圧についても調べました。図Aに時間分解発光顕微画像から構築されたりん光寿命イメージング画像を示します。画像の中心にカバーガラスのエッジがあり、左側の領域にある細胞はカバーガラスで覆われています。画像内の白線に沿ってりん光寿命をプロットすると、カバーガラスで覆われていない細胞のりん光寿命は約1 μsであるのに対して、エッジから内側になるにつれてりん光寿命が増加し、約400 μmでは約4 μsとなりました(図B)。これを酸素分圧イメージング画像に変換すると、カバーガラスの内側と外側の酸素分圧はそれぞれ約120 mmHg、5 mmHg以下であり、約400 μmにわたって酸素分圧勾配があることがわかりました(図C、D)。これは、側面から拡散した酸素が、エッジに近い細胞から内側にかけて徐々に消費されていくためです。これは組織において、毛細血管近傍の細胞では十分な酸素量があるのに対して、血管から遠くなると徐々に利用できる酸素量が減少することに対応しており、組織内の酸素分圧を考える上で良いモデル実験であると言えます。
現在は、BTPDM1を凌駕する高機能なIr錯体の開発や、マイクロプレートリーダーを用いた細胞内酸素レベル計測にも取り組んでいます。さらにIr錯体を用いた膜中の酸素拡散に関する研究も進めています。
組織内酸素分圧計測・イメージング
組織内の酸素分圧は、血管を通しての酸素供給と、細胞内における酸素消費によって恒常性が維持されています。また、血中酸素分圧は、動脈から静脈に向かって減少するため、動脈に近い細胞の方が使用できる酸素量は多くなり、結果として同じ組織おいても細胞内の酸素分圧は異なります。また、組織の代謝活動によっても酸素分圧は変化します。さらに、がんのような低酸素組織では、恒常性が破綻しているため、より複雑な状態になっています。このような不均一な酸素分圧の定量やイメージングは、培養細胞と比べて格段に難しくチャレンジングな研究テーマです。我々は、Ir錯体を酸素プローブとして、それらのりん光寿命イメージング測定から、マウス組織の酸素分圧計測・イメージングに取り組んでいます。これまでに、共同研究を含めて腎臓、肝臓、膵臓、眼底、骨髄の酸素分圧について明らかにしてきました。
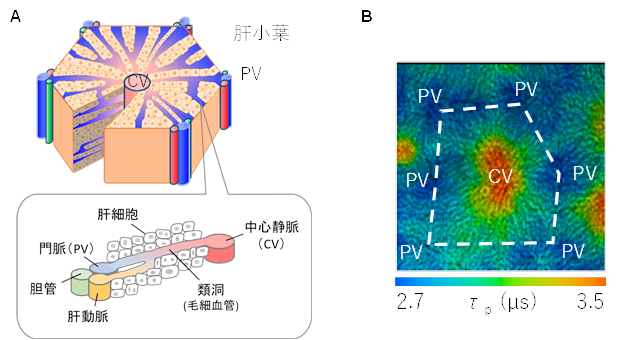
肝臓は、人体の中で最も大きな臓器であり、炭水化物、脂質、タンパク質の代謝や貯蔵、老廃物の分解や有害物質の解毒、消化のための胆汁の合成など多くの機能を担っています。肝臓は、六角柱構造をした肝小葉と呼ばれる基本単位から成り(図A)、六角柱の頂点部には肝動脈、門脈、胆管からなるPV(portal vein: PV)領域があり、中心部には中心静脈(central vein: CV)があります。血液はPV領域から類洞血管を経てCVに向かって流れています。血液中の酸素は、類洞血管に隣接する肝細胞に供給されるため、PV領域からCV領域に向かって徐々に減少します。これにより酸素分圧勾配が現れ、肝細胞の機能も変化することが指摘されています。よって、酸素分圧勾配をイメージングすることは、肝細胞内の代謝過程の解明において重要です。図Bに麻酔下にあるマウスにBTPDM1を尾静脈投与して、約20分後に測定した肝臓表面付近のりん光寿命イメージング画像を示します。りん光寿命が約2.5 μsの領域(PV領域)が、りん光寿命が約3.1 μsの領域(CV領域)を取り囲むようにあり、肝小葉がイメージングされています。また、PV領域からCV領域に向かってりん光寿命が徐々に増加していることから,酸素分圧勾配があることがわかりました。
現在は、正常組織だけでなく、がんなどの病態組織における酸素分圧計測・イメージングにも取り組んでいます。
レシオ型酸素プローブの開発
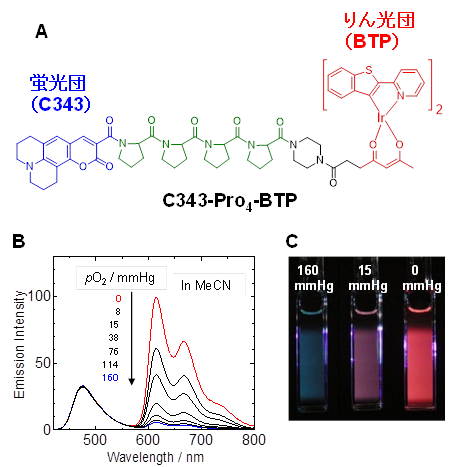
発光プローブを使って細胞や組織の中の酸素分圧を求めるには、発光寿命の測定が必要になります。一般に発光寿命は、レーザーのようなパルス光で細胞や組織内のIr錯体を光励起して、Ir錯体の発光の減衰を測定することによって求められます。そのため、特殊な顕微鏡を必要とします。このような特別な装置を使わずに酸素分圧を簡便に測定できる方法として、レシオ型酸素プローブ(図A)を設計、合成しました。この分子はクマリン343と呼ばれる蛍光団とりん光団であるイリジウム錯体BTPを、テトラプロリンをリンカーとして結合した構造をしています。ここで蛍光の強度は酸素分圧にほとんど依存しませんが、りん光は酸素分圧が高くなると弱くなる性質があるため、蛍光とりん光の強度比を測定することにより、プローブ分子周囲の酸素濃度を求めることができます。図Bは発光スペクトルが溶液の酸素分圧とともに変化する様子を、図Cはレシオ型酸素プローブを含んだ溶液の発光色が酸素分圧とともに変化する様子を示しています。
現在は、細胞親和性を高めるためのリンカーを設計・合成し、多くの研究者が自前の蛍光顕微鏡で測定できるプローブ分子の開発を進めています。
細胞内酸素消費速度計測
細胞内の酸素は、主にATP 合成のためにミトコンドリアの電子伝達系における最終電子受容体として消費されます。そのため、細胞内酸素レベルの変化、特に酸素レベルの低下は生命活動に大きな影響を及ぼします。何らかの原因によって、細胞内の酸素レベルが低下すると、通常酸素下においてタンパク質分解されていた低酸素誘導因子(HIF-1α)が安定となり、安定化したHIF-1α は、核内に移行し低酸素状態を解消するために様々な遺伝子の発現を上昇させることが知られています。例えば、がん組織のように低酸素環境下にある細胞では、酸素レベル低下によって、好気的代謝から嫌気的代謝になることで生成できるATP 量が大きく減少します。そのため、グルコーストランスポーター1 の発現量が増加し、グルコースの取り込み量を増加させたり、血管内皮細胞増殖因子の発現により無秩序な血管新生が促進されます。このように細胞は、酸素レベル変化に対して迅速に対応できる備えを有しています。一方、どのくらいの酸素レベルまで低下したら、このようなシステムは機能するのでしょうか。この疑問に対しては、細胞内・外の酸素レベルや酸素消費速度(OCR)を正確に測定することが必要となります。
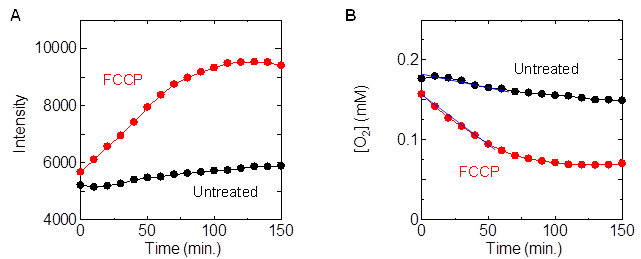
我々は、水溶性Ir錯体のりん光強度変化をマイクプレートリーダーで測定することで、簡便にOCRを測定できる方法論を明らかにしました。96ウェルプレートにヒト結腸腺癌由来の細胞を播種し、48時間培養後にIr錯体を含む培地で置換し、ミネラルオイルで封止したウェルと、封止直前に脱共役剤であるFCCPを添加したウェルについて、りん光強度測定を実施しました。図Aに示すように時間経過とともにりん光強度が増加し、また、増加の割合はFCCPを添加したウェルの方が未添加のウェルよりも大きいことがわかりました。これは細胞の酸素消費によって培養液中の酸素濃度が減少し、その減少速度はFCCPを添加することで速くなったためである。得られた酸素濃度の時間変化(図B)の初期(0-60 min)における傾きから、FCCPが未添加および添加された1ウェル当たりのOCRをそれぞれ30 pmol min-1、129 pmol min-1と求められました。各ウェル内の細胞数はほぼ同じであるため、FCCPを添加することで細胞のOCRが著しく増加することがわかりました。現在、この技術を利用した試薬キットが実用化されています。
バイオイメージングのための小分子蛍光・りん光プローブの開発
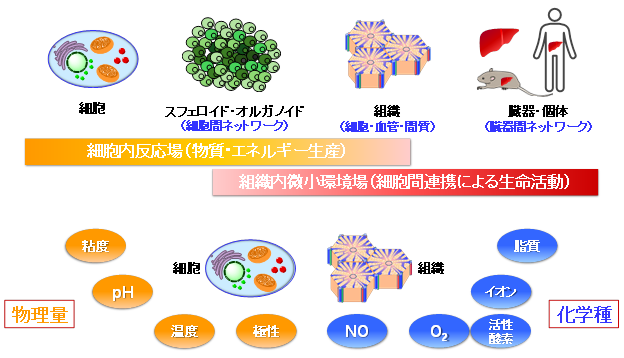
生命は細胞を基本単位として生命活動を維持しています。細胞は細胞膜によって外界から仕切られており、内部は様々な化学反応が効率的に進行するための特殊な「反応場」が形成されています。また、組織では血管や間質に加えて多様な細胞の集団化による「微小環境場」が形成されています。細胞内反応場や組織内微小環境場の恒常性の破綻は生命活動の危機に直結するため、これらの反応場や環境場の時間的・空間的なダイナミクスを理解するための様々な物理量(粘度、pH、温度、極性など)や化学種(脂質、イオン、O2、NO、活性酸素など)の定量化が世界中で進められています。しかし、細胞や組織は夾雑環境であるため、理想的な希釈溶液系で実施されてきた既存の方法では、狙った物理量や化学種を定量化することは未だ困難であり、ブレイクスルーを必要としています。
我々の研究室では、光化学的アプローチから夾雑環境にある細胞内反応場や組織内微小環境場の定量的なイメージング技術を創成し、生命現象の統合的な理解はもとより、創薬、診断、治療分野に貢献するブレイクスルーを生み出すことを目指しています。具体的には、分子の蛍光・りん光を利用した小分子センサーを開発し、それらセンサー分子の発光計測から、夾雑環境下においても狙った物理量や化学種を定量化できる方法論の確立を進めています。
脂質滴(脂肪滴)イメージングプローブの開発
脂質滴(脂肪滴)は、真核生物の細胞内に普遍的に存在する細胞内小器官であり、トリアシルグリセロールやコレステロールエステルなどの中性脂質が、膜タンパク質を含むリン脂質一重層膜に囲まれた構造をしています。これまで、脂質滴は過剰な脂質を蓄積するための単なる貯蔵器官として考えられてきましたが、近年、脂質代謝に関するタンパク質や酵素の発見に伴い、細胞内で動的に機能するオルガネラとして認識されています。また、個体レベルにおける脂質の過剰蓄積や代謝異常は、肥満、糖尿病、アテローム性動脈硬化症などの病気と関連しています。特に、肝臓内に中性脂質が過剰に蓄積する非アルコール性脂肪肝(炎)(NAFL: nonalcoholic fatty liver,NASH: nonalcoholic steatohepatitis)は、国内に約1,000万人以上いると推定されています。NAFL、NASHの発症メカニズムは未解明な部分が多く、また、NASHは放置すると肝硬変や肝がんへ進行することから、脂肪肝の段階で早期に発見することが重要とされています。このため、細胞や組織内の脂質滴の分布や量の計測、また、その形成・消滅過程をイメージングする研究が盛んに行われています。
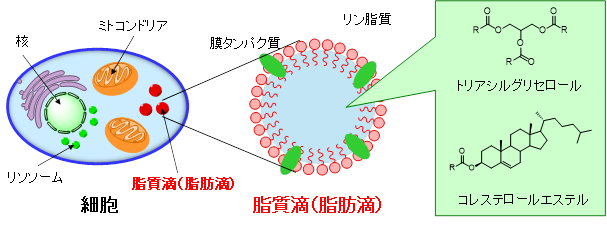
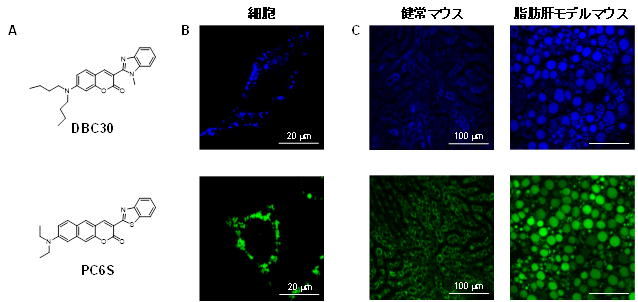
我々は、培養細胞だけでなく組織内の脂質滴をイメージングできるプローブ(DBC30、PC6S)を開発しました(図A)。これらのプローブを培養液に添加することで、細胞内の脂質滴を選択的に可視化できることを明らかにしました(図B)。また、麻酔下にある健常マウスや脂肪肝モデルマウスに投与することで肝臓の脂質滴および脂肪肝における脂肪滴の肥大化をイメージングすることに成功しました(図C)。
現在、DBC30、PC6Sは試薬会社を通して市販化されています。また、新しい蛍光性脂質滴イメージング試薬の開発も進めており、NAFL・NASHの発見、診断、治療法の開発への貢献が期待されています。
オルガネラ選択的蛍光・りん光プローブの開発
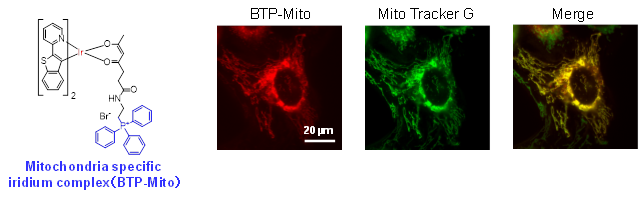
細胞内には、核、ミトコンドリア、小胞体、リソソームなど多種多様なオルガネラがあります。これらのオルガネラの細胞内分布をリアルタイムにイメージングすることで、多くの細胞内情報を得ることができます。また、各オルガネラはお互いが連携しているため、複数のオルガネラを同時にイメージングすることも重要です。
我々は、蛍光およびりん光性分子にオルガネラ選択的ユニットを結合させることで、狙ったオルガネラを選択的にイメージングできる分子の開発を進めています。また、異なる発光色のプローブ分子を開発することで、マルチカラーイメージングも実施しています。さらに、培養細胞内のオルガネラだけでなく、in vivoにおいても機能するプローブ分子の開発を目指しています。
血管イメージングプローブの開発
血管は、血液を通して組織細胞に栄養素や酸素を供給したり、老廃物や二酸化炭素を回収するための重要な組織です。このため、血管系の異常は生命活動の危機に直結します。特に血管の狭小化や蛇行は、組織に十分な酸素が供給されなくなり、組織の低酸素化を引き起こします。また、このような低酸素状態は“がん”に共通した特徴です。
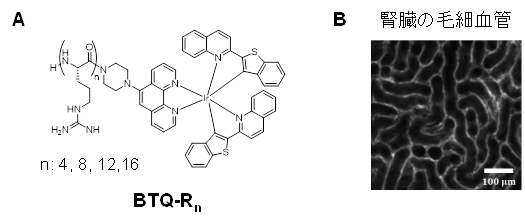
我々は、オリゴアルギニンペプチドを配位子に有するIr錯体(図A)が血管内皮に結合することを見出し、それらを用いて様々な正常組織や腫瘍組織の血管をイメージングすることに成功しました(図B)。Ir錯体の発光はりん光であるため、時間ゲート法を用いることで組織の自家蛍光を排除して血管だけをイメージングすることも可能です。さらに、研究室で開発した蛍光性脂質滴イメージング試薬(PC6S)と共投与することで、脂肪肝では、脂質滴の肥大化によって血管が狭小化したり蛇行する様子がイメージングされました。
現在は、血管内皮型に加えて血中循環型のイメージング試薬の開発も進めています。
新しいイメージングプローブの開発
バイオイメージングで対象とする物理量や化学種はたくさんあります。これらを明らかにするためには、狙った物理量や化学種のみをセンシング・イメージングできる分子が必要となり、1つ1つが新しい研究テーマです。我々の研究室では、新しい小分子蛍光あるいはりん光プローブを光化学的アプローチで設計し、有機化学的手法を駆使して合成しています。また、合成した分子の特性を調べ、改良することで実用化を目指しています。




